تغییر رنگ در ترکیبات شیمیایی : چگونه برخی مواد به محیط واکنش نشان میدهند؟
مقدمه
در دنیای شیمی، برخی ترکیبات بهگونهای طراحی شدهاند که نسبت به عوامل محیطی مانند رطوبت، دما و فشار واکنشهای ظاهری نشان میدهند. یکی از جذابترین این ترکیبات، موادی هستند که تغییر رنگ میدهند. این تغییر رنگ نهتنها در آزمایشگاهها بلکه در صنایع مختلف از جمله پزشکی، بستهبندی، حسگرها و صنایع هوافضا کاربردهای فراوانی دارد.
در این مقاله، نگاهی خواهیم داشت به مکانیزم تغییر رنگ در ترکیبات شیمیایی و یکی از مهمترین نمونهها یعنی کلرید کبالت را معرفی میکنیم.
تغییر رنگ در ترکیبات شیمیایی: علت چیست؟
تغییر رنگ در ترکیبات شیمیایی یکی از پدیدههای جذاب و مهم در شیمی معدنی و آلی است که میتواند دلایل مختلفی داشته باشد. این پدیده معمولاً به یکی از دلایل زیر رخ میدهد:
۱. تغییر در حالتهای اکسایش یون فلزی
یکی از رایجترین علل تغییر رنگ، تغییر در حالت اکسایش یونهای فلزی بهویژه فلزات واسطه (مانند کبالت، مس، آهن و منگنز) است. این فلزات دارای الکترونهای d هستند که میتوانند بین ترازهای انرژی مختلف جابجا شوند. این جابجایی باعث جذب نور در طول موجهای خاصی از طیف مرئی میشود و در نتیجه رنگ ماده تغییر میکند.
مثال: محلول سولفات آهن(II) به رنگ سبز است، اما اگر به آهن(III) تبدیل شود، رنگ آن به قهوهای متمایل به زرد تغییر میکند.
2. تغییر در ساختار بلوری یا کمپلکسهای کوئوردیناسیونی
ترکیبات یونی یا کوئوردینانسی (مانند کمپلکسهای فلزی) وقتی در محیطهای مختلف قرار میگیرند، ساختار هندسی یا تعداد لیگاندهای اطراف یون مرکزی ممکن است تغییر کند. این تغییرات میتواند باعث تغییر در جذب نور و در نتیجه تغییر رنگ شود.
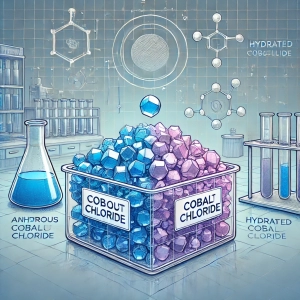
مثال: کلرید کبالت در حالت خشک به رنگ آبی است، اما زمانی که آب مولکولی جذب میکند و به فرم هگزاآکوا کلرید کبالت تبدیل میشود، رنگ آن به صورتی تغییر میکند.
3. تغییر در pH محیط
برخی ترکیبات در pHهای مختلف، ساختار مولکولی متفاوتی پیدا میکنند که باعث تفاوت در طیف نوری و رنگ آنها میشود. این ویژگی در بسیاری از اندیکاتورها (شناساگرهای اسیدی- بازی) مورد استفاده قرار میگیرد.
مثال: فنول فتالئین در محیط اسیدی بیرنگ است اما در محیط بازی به رنگ صورتی درمیآید.
4. واکنش با سایر ترکیبات یا تغییر در پیوندهای شیمیایی
برخی ترکیبات در صورت واکنش با دیگر مواد یا قرار گرفتن در معرض گازهایی مانند اکسیژن، کلر، آمونیاک یا دیاکسید کربن، ساختار شیمیاییشان تغییر میکند که این دگرگونی با تغییر رنگ همراه است.
مثال: نوارهای تست کلر یا آمونیاک بر اساس واکنش با گاز هدف و تغییر رنگ طراحی شدهاند.
5. اثرات دما و فشار
در برخی مواد، افزایش یا کاهش دما و فشار میتواند بر فاصله بین ترازهای انرژی تأثیر گذاشته و منجر به تغییر در نحوه جذب نور شود. این نوع ترکیبات در طراحی حسگرهای حرارتی (Thermochromic) و فشارسنجها مورد استفاده قرار میگیرند.
مثال: برخی رنگهای ترموکرومیک در ماگهای حرارتی یا برچسبهای دما استفاده میشوند که با گرما تغییر رنگ میدهند.
✅ نتیجهگیری کوتاه
تغییر رنگ در ترکیبات شیمیایی همیشه به یک دلیل خاص محدود نمیشود و میتواند ترکیبی از عوامل الکترونیکی، ساختاری، محیطی و واکنشی باشد. شناخت این پدیده نهتنها به درک بهتر ساختار مواد کمک میکند، بلکه در طراحی حسگرهای هوشمند، نشانگرهای محیطی و فرآیندهای کنترل کیفیت نقش کلیدی دارد.
کلرید کبالت؛ شاخصی حساس به رطوبت
یکی از معروفترین ترکیباتی که در واکنش به رطوبت محیط تغییر رنگ میدهد، کلرید کبالت (Cobalt(II) Chloride) است. این ماده در حالت خشک به رنگ آبی است، اما در صورت جذب رطوبت یا در تماس با آب، به رنگ صورتی تغییر میکند.
📌 برای آشنایی کامل با ساختار، ویژگیها و کاربردهای این ماده میتوانید مقالهی جامع ما با عنوان
کلرید کبالت چیست؟ | معرفی، ویژگیها، کاربردها و مزایا
را بخوانید.
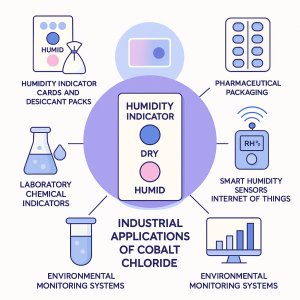
کاربردهای صنعتی ترکیبات حساس به تغییر رنگ
ترکیبات شیمیایی که در برابر عوامل محیطی مانند رطوبت، دما، pH، نور یا ترکیبات شیمیایی خاص تغییر رنگ میدهند، در دهههای اخیر جایگاه ویژهای در صنایع مختلف یافتهاند. این مواد که اغلب در دستهی ترکیبات کروموژنیک (chromogenic) یا مواد هوشمند قرار میگیرند، به دلیل واکنشپذیری بصری و غیرتهاجمی خود در طیف گستردهای از کاربردها استفاده میشوند.
در ادامه با مهمترین حوزههای صنعتی که از این مواد استفاده میکنند آشنا میشویم:
۱. صنعت بستهبندی و نگهداری مواد غذایی
✅ کاربرد:
-
استفاده از جوهرها یا برچسبهای حساس به دما یا رطوبت در بستهبندیهای هوشمند برای نشان دادن فساد یا تخریب محصول.
-
درج نشانگرهای تغییر رنگ در بستهبندیهای مواد غذایی یخزده برای نشان دادن تغییرات زنجیره سرد (cold chain).
🎯 مثال: برچسبهای رطوبتسنج در بستههای گوشت یا ماهی که در صورت افزایش رطوبت به رنگ خاصی در میآیند.
۲. حسگرهای رطوبت و نشانگرهای جذب رطوبت (Desiccant Indicators)
✅ کاربرد:
-
استفاده در تجهیزات الکترونیکی، دارویی و نظامی برای تشخیص نفوذ رطوبت به محفظهها.
-
استفاده در خشککنها، پاکتهای سیلیکاژل، کپسولهای دارویی و تجهیزات حساس.
🎯 مثال: کلرید کبالت یکی از رایجترین مواد در این کاربرد است که از آبی (خشک) به صورتی (مرطوب) تغییر رنگ میدهد.
۳. صنعت داروسازی و پزشکی
✅ کاربرد:
-
نشانگرهای تغییر رنگ برای بررسی شرایط نگهداری دارو یا تغییر در مواد فعال.
-
کاربرد در برچسبهای ایمنی، کیتهای تشخیص سریع و تستهای خانگی.
🎯 مثال: نوارهای تست ادرار یا تست بارداری که در اثر تماس با ترکیبات خاص تغییر رنگ میدهند.
۴. صنایع شیمیایی و نفت و گاز
✅ کاربرد:
-
استفاده از نشانگرهای تغییر رنگ برای تشخیص نشت گازها یا مواد خورنده.
-
کاربرد در شیلنگها، شیرآلات یا نقاط اتصال خطوط فرآیندی برای هشدار فوری.
🎯 مثال: نشانگرهای نشت آمونیاک یا کلر که در معرض گاز به رنگهای مشخصی واکنش نشان میدهند.
۵. مواد آموزشی و ابزارهای نمایشی
✅ کاربرد:
-
استفاده در آزمایشگاههای آموزشی برای نمایش واکنشهای شیمیایی و مفاهیم محیطی (مثل اسید و باز).
-
ابزارهای نمایشی در نمایشگاههای علمی یا محتوای آموزشی تعاملی.
🎯 مثال: نشانگرهای pH مانند فنول فتالئین یا متیل اورنج که با تغییر pH، رنگ متفاوتی پیدا میکنند.
۶. صنعت امنیت و جعلناپذیری (Anti-Counterfeiting)
✅ کاربرد:
-
استفاده از جوهرهای ترموکرومیک یا فتوشیمیایی در اسکناس، کارتهای اعتباری، پاسپورت و اسناد رسمی برای جلوگیری از جعل.
-
کاربرد در بستهبندی محصولات با ارزش بالا برای اثبات اصالت.
🎯 مثال: جوهرهای امنیتی که فقط در نور UV یا با گرما نمایان میشوند یا تغییر رنگ میدهند.
۷. سنسورها و پوششهای هوشمند در مهندسی پیشرفته
✅ کاربرد:
-
توسعه رنگهای هوشمند در خودروها، هواپیماها و سازهها که در برابر آسیب یا حرارت واکنش نشان میدهند.
-
طراحی پوششهایی که در برابر خوردگی یا افزایش دما، هشدار بصری میدهند.
🎯 مثال: رنگهایی که در صورت آسیب به پوشش ضدخوردگی روی بدنه هواپیما، تغییر رنگ داده و نیاز به تعمیر را نشان میدهند.
✅ نتیجهگیری
ترکیبات حساس به تغییر رنگ به دلیل واکنش سریع، هزینه کم، نصب آسان و عدم نیاز به تجهیزات پیچیده، به یکی از ابزارهای مؤثر در نظارت غیرفعال و هوشمند تبدیل شدهاند. با پیشرفت فناوری نانو و مواد هوشمند، انتظار میرود این حوزه در سالهای آینده رشد چشمگیری داشته باشد و در صنایع نوظهور مانند اینترنت اشیاء (IoT) و پوشیدنیهای هوشمند نیز جایگاه ویژهای پیدا کند.
جمعبندی
ترکیباتی مانند کلرید کبالت با قابلیت تغییر رنگ در برابر عوامل محیطی، دروازهای به سوی فناوریهای حسگرهای هوشمند گشودهاند. این مواد با ساختارهای خاص شیمیایی خود، در صنایع مختلف نقشی کلیدی ایفا میکنند. شناخت بهتر این ترکیبات میتواند مسیر را برای نوآوریهای بیشتر در حوزههای پزشکی، بستهبندی و محیطزیست هموار سازد.
📚 منابع پیشنهادی برای مقاله
-
PubChem – Cobalt(II) Chloride
https://pubchem.ncbi.nlm.nih.gov/compound/Cobalt-II-chloride
✔️ پایگاه دادهی رسمی و علمی با اطلاعات کامل درباره کلرید کبالت (خواص، ایمنی، کاربردها). -
Sigma-Aldrich – Cobalt(II) chloride
https://www.sigmaaldrich.com/IR/en/product/sial/255599
✔️ اطلاعات فنی و کاربردی از تولیدکننده معتبر مواد شیمیایی. -
ScienceDirect – Articles on Thermochromic and Hygroscopic Materials
https://www.sciencedirect.com/topics/chemistry/thermochromic-materials
✔️ مجموعهای از مقالات علمی در مورد مواد تغییر رنگدهنده. -
ResearchGate – Cobalt Chloride Humidity Indicator
https://www.researchgate.net/publication/327356046_Cobalt_Chloride_as_a_Humidity_Indicator
✔️ مقالهای تخصصی دربارهی استفاده از کلرید کبالت بهعنوان نشانگر رطوبت. -
ISO 11140-1:2014 – Sterilization of health care products — Chemical indicators
https://www.iso.org/standard/54986.html
✔️ استاندارد بینالمللی مرتبط با شاخصهای شیمیایی تغییر رنگدهنده در تجهیزات پزشکی. -
American Chemical Society – Color Changes in Transition Metal Complexes
https://www.acs.org (جستجوی داخلی: color change transition metal complexes)
✔️ مقالات آموزشی و علمی در خصوص مکانیسم تغییر رنگ فلزات واسطه. -
Springer – Chromogenic Materials
https://link.springer.com (جستجوی داخلی: chromogenic materials review)
✔️ منابع مرور (Review Paper) دربارهی مواد کروموژنیک و کاربردهای آنها.