بررسی پدیده تفرق لیگاندی در ساختارهای کمپلکس کلرید کبالت
🧪 مقدمه
کلرید کبالت (Cobalt(II) chloride) یکی از ترکیبات شناختهشده و پرکاربرد کبالت است که به دلیل تواناییاش در تشکیل کمپلکسهای رنگی با لیگاندهای مختلف، مورد توجه گسترده قرار گرفته است. یکی از جالبترین ویژگیهای آن، تغییر رنگ قابل مشاهده در شرایط مختلف مانند حضور یا عدم حضور آب (رطوبت) است. این پدیده نهتنها کاربرد عملی دارد، بلکه بهعنوان یک نمونهی عالی برای درک مفاهیم شیمی معدنی مانند تفرق لیگاندی (Ligand Field Theory) و جابجایی لیگاندها در کمپلکسهای فلزی شناخته میشود.
⚛️ ساختار شیمیایی و خواص کلرید کبالت
-
فرمول مولکولی: CoCl₂
-
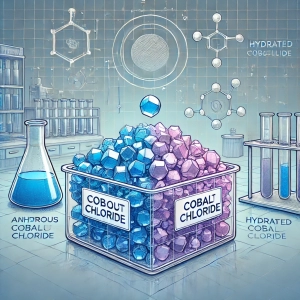
شکل ظاهری: بنفش یا آبی (بیآب)، صورتی (هیدراته)
-
ساختار الکترونی: [Ar] 3d⁷
-
توانایی کمپلکسسازی: بالا، بهویژه با لیگاندهای N و O دار
🎨 عوامل مؤثر در تغییر رنگ کلرید کبالت: بررسی ساختاری، شیمیایی و محیطی
تغییر رنگ کلرید کبالت (CoCl₂) بهویژه بین رنگ صورتی و آبی، نمونهای بسیار واضح و قابل مشاهده از رفتار کمپلکسهای فلزی در پاسخ به شرایط محیطی است. این تغییر رنگ ناشی از تغییر نوع کمپلکس تشکیلشده بین یون کبالت (II) و لیگاندهایی مانند آب یا کلرید است.
در ادامه به بررسی عمیقتر عوامل مؤثر در این پدیده میپردازیم:
🧪 1. غلظت آب (رطوبت محیط یا حلال)
-
در حضور آب (محیط مرطوب):
یون Co²⁺ با ۶ مولکول آب ترکیب میشود و کمپلکس [Co(H₂O)₆]²⁺ را تشکیل میدهد که دارای ساختار اُکتاهدرال و رنگ صورتی است. -
در محیط خشک (بیآب):
مولکولهای آب جای خود را به یونهای کلرید میدهند و کمپلکس [CoCl₄]²⁻ با ساختار تتراهدرال و رنگ آبی تشکیل میشود.
🔁 واکنش برگشتپذیر:
[Co(H2O)6]2+⇌[CoCl4]2−+6H2O[Co(H₂O)₆]^{2+} \rightleftharpoons [CoCl₄]^{2-} + 6H₂O
بنابراین، رطوبت یکی از مهمترین عوامل تغییر رنگ در کلرید کبالت است، بههمین دلیل در رطوبتسنجهای بصری از آن استفاده میشود.
🌡 2. دما (گرما یا سرمای محیط)
افزایش دما باعث دفع مولکولهای آب از کمپلکس صورتی و تشکیل کمپلکس آبی میشود.
در واقع، طبق اصل لوشاتلیه (Le Chatelier’s Principle)، افزایش دما تعادل را به سمت تشکیل کمپلکس بیآب و آزاد شدن آب سوق میدهد:
گرما ⇨ افزایش CoCl₄²⁻ ⇨ رنگ آبی\text{گرما ⇨ افزایش CoCl₄²⁻ ⇨ رنگ آبی}
بنابراین:
-
دما بالا ⇨ آبی
-
دما پایین ⇨ صورتی
این خاصیت را میتوان برای ساخت سنسورهای حرارتی یا نشانگرهای تغییر دما نیز بهکار گرفت.
🧪 3. نوع و قطبیت حلال
-
در حلالهای قطبی مانند آب یا اتانول: کمپلکسهای آبدار (hydrated) پایدارترند → رنگ صورتی
-
در حلالهای غیرقطبی یا خشک مانند استون یا اتر: لیگاندهای آبی بهراحتی جایگزین میشوند → رنگ آبی یا بنفش
برخی حلالها همچنین ممکن است بهعنوان لیگاند عمل کنند و در ساختار کمپلکس شرکت نمایند، مانند دیمتیلفرمامید (DMF) یا استونیتریل.
🧂 4. ترکیب یونی محیط (اثر یون مشترک یا نمکها)
افزایش غلظت یون کلرید (Cl⁻) در محیط باعث میشود که Co²⁺ ترجیح بدهد بهجای H₂O با یونهای Cl⁻ کمپلکس تشکیل دهد:
-
افزایش NaCl → افزایش [CoCl₄]²⁻ → رنگ آبی تقویت میشود
برعکس، رقیق کردن یا کاهش یون Cl⁻ موجب برگشت به حالت صورتی میشود.
⚗️ 5. pH محلول
-
در محیط اسیدی ملایم، کمپلکس آبدار پایدار است → رنگ صورتی
-
در pH بالا (قلیایی)، تشکیل رسوب کبالت یا کمپلکسهای دیگر ممکن است باعث اختلال در رنگ معمول شود
همچنین pH میتواند بر میزان یونیزاسیون لیگاندهای موجود اثر گذاشته و توازن کمپلکسها را تغییر دهد.
🧬 6. فشار بخار آب محیطی (رطوبت نسبی هوا)
کلرید کبالت بهشدت جذبکننده رطوبت است (hygroscopic)؛ بههمین دلیل حتی در قالب جامد (مثلاً روی کاغذ نشانگر) نیز با تغییر فشار بخار آب، رنگش عوض میشود:
-
رطوبت نسبی بالا ⇨ صورتی
-
هوای خشک ⇨ آبی
بههمین دلیل در آزمایشگاهها و بستهبندی صنعتی از آن بهعنوان نشانگر رطوبت هوا استفاده میشود.
🔍 7. میزان نور و تابش فرابنفش (در موارد خاص)
اگرچه نور معمولی اثر قابلتوجهی بر ساختار کمپلکس CoCl₂ ندارد، ولی در شرایط تابش شدید فرابنفش یا نور لیزر در برخی تحقیقات، تغییرات فوتوشیمیایی در کمپلکسها گزارش شده است. این مورد در طراحی مواد حساس به نور یا فوتوکرومیک کاربرد پژوهشی دارد.
⚙️ کاربردهای صنعتی و آزمایشگاهی
-
سنسور رطوبت: در سیلیکاژلهای نشانگر رطوبت از کلرید کبالت برای تغییر رنگ استفاده میشود.
-
آموزش در شیمی معدنی: بهعنوان مثالی ساده و دیداری برای توضیح مفاهیم کمپلکس و تفرق لیگاندی.
-
کاتالیزور: در برخی واکنشهای آلی بهعنوان کاتالیزور استفاده میشود که مکانیسم آن به ساختار کمپلکس بستگی دارد.
🔬 نقش کلرید کبالت در واکنشهای معدنی
۱. تشکیل کمپلکسهای معدنی
CoCl₂ با لیگاندهایی مانند آمونیاک، اتیلندیآمین، پیریدین، و آب کمپلکسهای متنوعی تشکیل میدهد که رنگ، ساختار و خواص متفاوتی دارند.
✅ مثال:
تشکیل کمپلکس هگزاآکوکبالت (II):
CoCl₂ + 6H₂O → [Co(H₂O)₆]Cl₂\text{CoCl₂ + 6H₂O → [Co(H₂O)₆]Cl₂}
۲. شناسایی رطوبت (حسگر شیمیایی)
از خاصیت تغییر رنگ CoCl₂ در محیط مرطوب استفاده میشود تا میزان رطوبت را بهصورت دیداری تشخیص داد.
۳. تشکیل کمپلکسهای انتقال بار (Charge-Transfer Complexes)
در محیطهایی با لیگاندهای π-پذیر، CoCl₂ میتواند کمپلکسهایی با انتقال الکترونی تشکیل دهد که در اسپکتروسکوپی مطالعه میشوند.
⚠️ نکات ایمنی و زیستمحیطی
کلرید کبالت مادهای سمی و سرطانزا (Carcinogenic) محسوب میشود. تماس طولانی با آن (تنفسی یا پوستی) خطرناک است و باید در محیط کنترلشده استفاده شود. استفاده در محصولات مصرفی به شدت محدود یا ممنوع شده است.
📌 نتیجهگیری
تغییر رنگ کلرید کبالت یک پدیده ظاهراً ساده ولی علمی و کاربردی است که مفاهیمی مانند پویایی کمپلکسها، تعادل شیمیایی، و نظریه میدان لیگاند را بهخوبی نمایش میدهد. شناخت دقیق این رفتار میتواند در توسعه سنسورها، طراحی داروهای فلزی، و درک بهتر ساختارهای کمپلکس کمک کند.
| عامل | کمپلکس غالب | ساختار | رنگ |
|---|---|---|---|
| رطوبت بالا | [Co(H₂O)₆]²⁺ | اُکتاهدرال | صورتی |
| محیط خشک | [CoCl₄]²⁻ | تتراهدرال | آبی |
| دمای بالا | [CoCl₄]²⁻ | تتراهدرال | آبی |
| دمای پایین | [Co(H₂O)₆]²⁺ | اُکتاهدرال | صورتی |
| حلال قطبی | [Co(H₂O)₆]²⁺ | اُکتاهدرال | صورتی |
| غلظت بالای Cl⁻ | [CoCl₄]²⁻ | تتراهدرال | آبی |
منابع مقاله
- Cotton, F. A., Wilkinson, G. (1999).
Advanced Inorganic Chemistry (6th Edition). Wiley-Interscience.
↪ مرجع کلاسیک در زمینه ساختار و واکنش کمپلکسهای معدنی مانند کمپلکسهای کبالت.
Inorganic Chemistry (5th Edition). Pearson Education.
↪ پوشش دقیق ساختارهای تتراهدرال و اُکتاهدرال در کمپلکسهای فلزی.
- Greenwood, N. N., Earnshaw, A. (1997).
Chemistry of the Elements (2nd Edition). Butterworth-Heinemann.
↪ اطلاعات کامل درباره ترکیبات کبالت، کمپلکسهای آبی و یون کلرید.
- Harris, D. C. (2015).
Quantitative Chemical Analysis (9th Edition). W. H. Freeman.
↪ تحلیلهای کمی، رفتار تعادلی کمپلکسها، اصل لوشاتلیه و رنگسنجی.
- Chang, R. (2010).
General Chemistry: The Essential Concepts (6th Edition). McGraw-Hill.
↪ پایهگذاری مفاهیم رفتار رنگی مواد در شرایط مختلف.
Investigation of Ligand Field Splitting in Cobalt Chloride Complex Structures
🧪 Introduction
Cobalt(II) chloride (CoCl₂) is one of the most well-known and widely used cobalt compounds, particularly due to its ability to form colored complexes with various ligands. One of its most fascinating properties is its visible color change under different conditions, such as the presence or absence of water (humidity). This phenomenon not only has practical applications but also serves as an excellent example for understanding key inorganic chemistry concepts such as Ligand Field Theory and ligand exchange in metal complexes.
⚛️ Chemical Structure and Properties of Cobalt Chloride
-
Molecular Formula: CoCl₂
-
Appearance: Purple or blue (anhydrous), pink (hydrated)
-
Electronic Configuration: [Ar] 3d⁷
-
Solubility: Highly soluble in water and short-chain alcohols
-
Complexation Ability: High, especially with ligands containing nitrogen or oxygen atoms
🎨 Factors Affecting the Color Change of Cobalt Chloride: Structural, Chemical, and Environmental Analysis
The color change of cobalt chloride (CoCl₂), especially between pink and blue, is a striking and observable example of how metal complexes respond to environmental conditions. This color change is due to the alteration in the type of complex formed between Co²⁺ ions and ligands such as water or chloride ions.
Let’s delve deeper into the key factors contributing to this phenomenon:
🧪 1. Water Concentration (Environmental or Solvent Humidity)
-
In humid environments (presence of water):
The Co²⁺ ion binds with 6 water molecules to form the [Co(H₂O)₆]²⁺ complex, which has an octahedral geometry and appears pink. -
In dry environments (absence of water):
Water molecules are replaced by chloride ions, forming the [CoCl₄]²⁻ complex, which has a tetrahedral geometry and appears blue. -
Reversible Reaction:
[Co(H2O)6]2+⇌[CoCl4]2−+6H2O[Co(H₂O)₆]^{2+} \rightleftharpoons [CoCl₄]^{2-} + 6H₂O
Hence, humidity is one of the most influential factors in cobalt chloride’s color change, which is why it is used in visual humidity indicators.
🌡 2. Temperature (Environmental Heat or Cold)
-
Increased temperature leads to the removal of water molecules from the pink complex and the formation of the blue complex.
-
According to Le Chatelier’s Principle, increasing the temperature shifts the equilibrium toward the anhydrous complex:
Heat ⇨ More [CoCl₄]²⁻ ⇨ Blue Color
-
Therefore:
High temperature ⇨ Blue
Low temperature ⇨ Pink
This property allows the use of cobalt chloride in thermal sensors or temperature indicators.
🧪 3. Solvent Type and Polarity
-
In polar solvents like water or ethanol: hydrated complexes are more stable → pink color
-
In non-polar or dry solvents like acetone or ether: water ligands are easily replaced → blue or purple color
Some solvents may also act as ligands themselves, such as DMF (dimethylformamide) or acetonitrile.
🧂 4. Ionic Composition of the Environment (Common Ion Effect or Salts)
-
Increasing the concentration of chloride ions (Cl⁻) encourages the formation of the blue [CoCl₄]²⁻ complex.
More NaCl ⇨ More [CoCl₄]²⁻ ⇨ Blue Color
-
Conversely, diluting or decreasing Cl⁻ concentration shifts the equilibrium back to the pink complex.
⚗️ 5. Solution pH
-
Mildly acidic conditions: stabilize the hydrated complex → pink color
-
High pH (alkaline): may lead to cobalt precipitation or formation of other complexes that disrupt the typical color response.
pH also influences the ionization of available ligands, altering the balance of complex formation.
🧬 6. Water Vapor Pressure (Relative Humidity of Air)
Cobalt chloride is highly hygroscopic, so even in solid form (e.g., on indicator paper), it changes color based on the ambient water vapor pressure:
-
High relative humidity ⇨ Pink
-
Dry air ⇨ Blue
That’s why it is widely used in laboratories and industrial packaging as a moisture indicator.
🔍 7. Light and Ultraviolet Radiation (in Specific Cases)
While normal light has little effect on CoCl₂ complexes, strong UV or laser radiation has been reported to cause photochemical changes in some research cases. This has potential applications in light-sensitive or photochromic materials.
⚙️ Industrial and Laboratory Applications
-
Humidity Sensors: Used in silica gels as a color-changing moisture indicator
-
Teaching Tool: A visual and simple example for demonstrating concepts like ligand field splitting in inorganic chemistry
-
Catalysis: Acts as a catalyst in some organic reactions, where the mechanism depends on its complex structure
🔬 Role of Cobalt Chloride in Inorganic Reactions
1. Formation of Inorganic Complexes
CoCl₂ forms a variety of complexes with ligands like ammonia, ethylenediamine, pyridine, and water, each with different colors, structures, and properties.
✅ Example:
Formation of hexaaquacobalt(II) complex:
CoCl₂ + 6H₂O → [Co(H₂O)₆]Cl₂
2. Humidity Detection (Chemical Sensing)
The color change of CoCl₂ is used to visually detect moisture levels.
3. Charge-Transfer Complexes
In the presence of π-acceptor ligands, CoCl₂ can form electron-transfer complexes studied in spectroscopy.
⚠️ Safety and Environmental Notes
Cobalt chloride is considered toxic and carcinogenic. Prolonged exposure (inhalation or skin contact) is hazardous and should only be handled in controlled environments. Its use in consumer products is strictly limited or banned.
📌 Conclusion
The color change of cobalt chloride is a seemingly simple but scientifically rich and practical phenomenon. It vividly demonstrates concepts like complex dynamics, chemical equilibrium, and Ligand Field Theory. A deep understanding of this behavior can aid in sensor development, design of metal-based drugs, and better comprehension of complex structures.
| Factor | Dominant Complex | Geometry | Color |
|---|---|---|---|
| High Humidity | [Co(H₂O)₆]²⁺ | Octahedral | Pink |
| Dry Environment | [CoCl₄]²⁻ | Tetrahedral | Blue |
| High Temperature | [CoCl₄]²⁻ | Tetrahedral | Blue |
| Low Temperature | [Co(H₂O)₆]²⁺ | Octahedral | Pink |
| Polar Solvent | [Co(H₂O)₆]²⁺ | Octahedral | Pink |
| High Cl⁻ Concentration | [CoCl₄]²⁻ | Tetrahedral | Blue |
📚 References
-
Cotton, F. A., Wilkinson, G. (1999). Advanced Inorganic Chemistry (6th Edition). Wiley-Interscience.
↪ A classic reference on the structure and reactivity of inorganic complexes including cobalt. -
Housecroft, C. E., Sharpe, A. G. (2018). Inorganic Chemistry (5th Edition). Pearson Education.
↪ Detailed coverage of tetrahedral and octahedral geometries in metal complexes. -
Greenwood, N. N., Earnshaw, A. (1997). Chemistry of the Elements (2nd Edition). Butterworth-Heinemann.
↪ Comprehensive information on cobalt compounds, hydrated complexes, and chloride ion chemistry. -
Harris, D. C. (2015). Quantitative Chemical Analysis (9th Edition). W. H. Freeman.
↪ Quantitative behavior, equilibrium dynamics, and colorimetry applications. -
Chang, R. (2010). General Chemistry: The Essential Concepts (6th Edition). McGraw-Hill.
↪ Foundation of how substances behave colorimetrically under different conditions.