کاتالیزور چیست؟ | معرفی، انواع، عملکرد و کاربردها
🔹 مقدمه
کاتالیزورها از مهمترین عناصر در دنیای شیمی و صنعت هستند که بدون آنها بسیاری از واکنشهای شیمیایی غیرممکن یا بسیار کند خواهند بود. از تولید دارو و پلاستیک گرفته تا پالایش نفت و تصفیه آب، کاتالیزور نقش کلیدی در تسریع واکنشها و بهینهسازی مصرف انرژی ایفا میکند. در این مقاله بهصورت دقیق بررسی میکنیم که کاتالیزور چیست، چگونه عمل میکند، چه انواعی دارد و در کجاها کاربرد دارد.
1.مقدمه
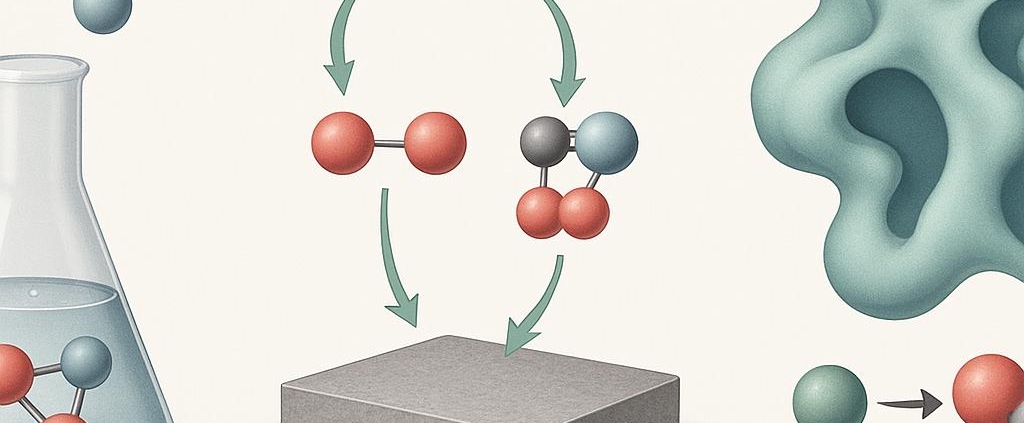
کاتالیزور (Catalyst) مادهای است که سرعت یک واکنش شیمیایی را افزایش میدهد بدون اینکه خودش در پایان واکنش مصرف شود یا تغییر شیمیایی دائمی پیدا کند. کاتالیزور با کاهش انرژی فعالسازی (Activation Energy) مورد نیاز، مسیر واکنش را کوتاهتر یا آسانتر میکند.
مثال ساده: آنزیمهای گوارشی در بدن انسان کاتالیزورهایی هستند که تجزیه غذا را در دمای بدن ممکن میسازند.
🔹 2. عملکرد کاتالیزور چگونه است؟
کاتالیزور در طول واکنش وارد مسیر میشود و با یکی از مواد واکنشدهنده ترکیب موقتی تشکیل میدهد (کمپلکس فعال)، سپس این ترکیب به محصول نهایی تبدیل شده و خود کاتالیزور دوباره آزاد میشود.
✅ نتایج عملکرد کاتالیزور:
-
کاهش انرژی فعالسازی
-
افزایش سرعت واکنش
-
انتخابپذیری بیشتر در تولید محصول
-
صرفهجویی در انرژی، زمان و مواد اولیه
🔹 ۳. انواع کاتالیزورها
کاتالیزورها بهطور کلی به سه دسته اصلی تقسیم میشوند: همگن (Homogeneous)، ناهمگن (Heterogeneous) و زیستی (Biocatalysts). در برخی دستهبندیهای پیشرفته، انواع خاصتری نیز مانند کاتالیزورهای آنزیمی، نانوساختاری یا فوتوکاتالیزورها نیز ذکر میشوند. در این بخش، به معرفی هر یک همراه با ویژگیها و کاربردهای خاصشان میپردازیم.
۳-۱. کاتالیزور همگن (Homogeneous Catalysts)
🧪 تعریف:
کاتالیزورهایی که با واکنشدهندهها در یک فاز (معمولاً مایع) قرار دارند. این نوع کاتالیزورها اغلب در محلول حل شده و با واکنشدهندهها تماس مستقیم مولکولی دارند.
⚙️ مکانیزم عملکرد:
کاتالیزور در محلول با یکی از مواد واکنشدهنده وارد واکنش شده، یک ترکیب واسط (کمپلکس فعال) تشکیل میدهد که سپس به محصول تبدیل میشود. در پایان، کاتالیزور بازیابی میشود.
✅ مزایا:
توزیع یکنواخت در فاز واکنش
راندمان بالا بهدلیل تماس مستقیم با واکنشدهنده
مناسب برای واکنشهای دقیق و کنترلشده
❌ معایب:
بازیابی و جداسازی دشوار از مخلوط نهایی
پایداری کمتر در شرایط دمایی بالا یا pHهای شدید
📌 مثالها:
اسید سولفوریک در واکنش استریفیکاسیون
کمپلکسهای پالادیم در واکنشهای آلی مانند Suzuki و Heck
پرمنگنات پتاسیم در واکنشهای اکسایش آلی
۳-۲. کاتالیزور ناهمگن (Heterogeneous Catalysts)
🧪 تعریف:
کاتالیزورهایی که در فازی متفاوت با واکنشدهندهها قرار دارند (معمولاً جامد در واکنشهای مایع یا گاز). رایجترین نوع در صنعت است.
⚙️ مکانیزم عملکرد:
واکنشدهندهها روی سطح فعال کاتالیزور جذب میشوند، واکنش شیمیایی روی سطح انجام شده، سپس محصولات از سطح جدا میشوند و کاتالیزور باقی میماند.برخی نمکهای فلزی مانند استات کبالت در واکنشهای اکسایش و پلیمریزاسیون بهعنوان کاتالیزور ناهمگن استفاده میشوند.
✅ مزایا:
جداسازی آسان از محصول نهایی
بازیافت و استفاده مجدد ساده
پایداری بالا در دما و فشار زیاد
❌ معایب:
سطح تماس محدود
احتمال مسمومیت سطحی (Catalyst Poisoning) با ناخالصیها
نیاز به فعالسازی سطحی و ساختار متخلخل دقیق
📌 مثالها:
نیکل در هیدروژناسیون روغنهای نباتی
اکسید وانادیم در تولید اسید سولفوریک (واکنش تماس)
پلاتین یا پالادیم در مبدلهای کاتالیستی خودرو
۳-۳. کاتالیزور زیستی (Biocatalysts یا آنزیمها)
🧬 تعریف:
کاتالیزورهایی که بهصورت طبیعی در موجودات زنده تولید میشوند (آنزیمها). این کاتالیزورها بسیار تخصصی، مؤثر و سازگار با محیط زیست هستند.
⚙️ مکانیزم عملکرد:
آنزیمها معمولاً دارای جایگاه فعال (Active Site) هستند که تنها با واکنشدهنده خاصی پیوند مییابد و واکنش را با سرعت بالا پیش میبرد.
✅ مزایا:
بسیار انتخابپذیر (Selectivity بالا)
فعال در دمای پایین و فشار معمولی
قابل تجزیه زیستی و ایمن برای محیط زیست
❌ معایب:
حساس به شرایط محیطی (دما، pH)
هزینه تولید بالا
عمر عملیاتی محدود در برخی فرآیندها
📌 مثالها:
آنزیم زیماز در تخمیر قند به الکل
آمیلاز در تجزیه نشاسته
لیپاز در ساخت مواد دارویی و شویندهها
پروتئاز در صنایع غذایی و پاککنندهها
ترکیباتی مانند استات کبالت، در دسته کاتالیزورهای قابلاستفاده در فرآیندهای نانوکاتالیستی و زیستسازگار نیز طبقهبندی میشوند.
🎯 جمعبندی بخش سوم:
نوع کاتالیزور مناسب باید با توجه به فاز واکنش، حساسیت به شرایط، نیاز به بازیافت، و نوع محصول انتخاب شود. شناخت تفاوتهای همگن، ناهمگن و زیستی، مسیر طراحی واکنشها را روشنتر میسازد و بهرهوری صنعتی را افزایش میدهد.
🔹 4. ویژگیهای یک کاتالیزور خوب
یک کاتالیزور مؤثر باید ویژگیهای زیر را داشته باشد:
| ویژگی | توضیح |
|---|---|
| فعالیت بالا | واکنش را با سرعت مناسب پیش ببرد |
| پایداری | در شرایط عملیاتی تخریب نشود |
| انتخابپذیری | محصول دلخواه را ترجیحاً تولید کند |
| بازیافتپذیری | پس از پایان واکنش قابل بازیابی و استفاده مجدد باشد |
| سمی نبودن | برای محیط زیست و انسان بیخطر باشد |
🔹 5. کاربردهای کاتالیزور
صنایع شیمیایی و نفت:
-
تولید آمونیاک با استفاده از کاتالیزور آهن (فرآیند هابر)
-
تصفیه نفت خام با استفاده از کاتالیزورهای اسیدی
-
پالایش بنزین و حذف آلایندهها مانند گوگرد
صنایع داروسازی:
-
تولید داروهای ضد سرطان، آنتیبیوتیکها و مواد فعال زیستی با دقت بالا
محیط زیست:
-
کاتالیزور در مبدل کاتالیستی خودروها برای تبدیل گازهای سمی به گازهای بیضرر
-
تصفیه فاضلاب و حذف آلایندههای آلی و معدنی
صنایع غذایی:
-
استفاده از آنزیمها برای تولید نان، ماست، پنیر و آبمیوه
فناوری نانو:
-
کاتالیزورهای نانوساختار برای واکنشهای دقیق و کممصرف
🔹 6. مثالهایی از کاتالیزورهای معروف
| واکنش | کاتالیزور | نوع |
|---|---|---|
| هابر – تولید آمونیاک | آهن | ناهمگن |
| هیدروژناسیون روغن | نیکل | ناهمگن |
| استریفیکاسیون | H₂SO₄ | همگن |
| تخمیر گلوکز | آنزیمها (زیماز) | زیستی |
🔹 7. چالشها و آینده کاتالیزورها
کاتالیزورها در عین حال که سودآور و کارآمد هستند، چالشهایی نیز دارند، مانند:
-
هزینه بالای برخی فلزات (مثلاً پلاتین یا رودیوم)
-
سمیت یا آلودگی زیستمحیطی بعضی ترکیبات
-
کاهش بازدهی پس از چند بار استفاده
🔬 با پیشرفت فناوری نانو، طراحی کاتالیزورهای هوشمند، خودبازسازیشونده و سبز در دستور کار آینده قرار دارد.
🔹 نتیجهگیری
کاتالیزورها قلب تپندهی فرآیندهای شیمیایی و زیستی هستند. آنها با تسریع واکنشها، کاهش هزینهها و افزایش بهرهوری، ستون فقرات بسیاری از صنایع مدرن محسوب میشوند. شناخت انواع و نحوه عملکرد کاتالیزورها، کلید طراحی بهتر واکنشها در آزمایشگاه و صنعت است.
📚 منابع علمی و فنی همراه با لینک
-
Atkins’ Physical Chemistry – Oxford University Press
مرجع شناختهشده در شیمی فیزیک و ترمودینامیک واکنشها
🔗 https://global.oup.com/academic/product/atkins-physical-chemistry-9780198769866
-
Catalysis: Concepts and Green Applications – Gadi Rothenberg (Wiley)
کتاب معتبر در زمینه کاتالیز سبز و طراحی فرآیندهای شیمیایی
🔗 https://www.wiley.com/en-us/Catalysis%3A+Concepts+and+Green+Applications-p-9783527316519
-
Journal of Catalysis – Elsevier
ژورنال علمی پیشرو در حوزه نظری و صنعتی کاتالیز
🔗 https://www.sciencedirect.com/journal/journal-of-catalysis
-
Chemical Reviews – American Chemical Society (ACS)
مرجع مقالات مروری عمیق و پژوهشی در حوزه کاتالیز و شیمی معدنی
🔗 https://pubs.acs.org/journal/chreay
-
BASF Catalysts
تولیدکننده بینالمللی کاتالیزورهای صنعتی در فرآیندهای نفت، گاز و مواد شیمیایی
🔗 https://www.catalysts.basf.com
-
Johnson Matthey – Catalysts & Technologies
شرکت معتبر در زمینه توسعه کاتالیزورهای زیستمحور و صنعتی
🔗 https://www.matthey.com/products-and-services/catalysts
What Is a Catalyst? | Definition, Types, Function, and Applications
Introduction
Catalysts are among the most vital components in the fields of chemistry and industry. Without them, many chemical reactions would either not occur or proceed extremely slowly. From pharmaceutical production and plastic manufacturing to petroleum refining and water treatment, catalysts play a crucial role in accelerating reactions and optimizing energy use. This article comprehensively explores what a catalyst is, how it works, the different types, and their real-world applications.
1. What Is a Catalyst?
A catalyst is a substance that increases the rate of a chemical reaction without being consumed or undergoing permanent chemical change. By lowering the activation energy required, the catalyst provides a more efficient pathway for the reaction.
Simple Example: Digestive enzymes in the human body are natural catalysts that enable food breakdown at body temperature.
2. How Does a Catalyst Work?
During the reaction, a catalyst temporarily interacts with one of the reactants, forming an intermediate compound. This intermediate then converts into the final product, releasing the catalyst unchanged.
Key outcomes of catalyst function:
- Reduces activation energy
- Increases reaction rate
- Enhances product selectivity
- Saves time, energy, and raw materials
3. Types of Catalysts
Catalysts are mainly categorized into three types:
3.1 Homogeneous Catalysts
These catalysts exist in the same phase (usually liquid) as the reactants.
- Example: Sulfuric acid in esterification reactions
Pros: Uniform distribution, high reactivity Cons: Difficult to separate and recover
3.2 Heterogeneous Catalysts
These catalysts exist in a different phase (usually solid) from the reactants.
- Example: Solid nickel in the hydrogenation of vegetable oils
Pros: Easy separation, reusable, stable under high temperatures Cons: Limited surface interaction, potential deactivation
3.3 Biocatalysts (Enzymes)
Biological catalysts found in living organisms.
- Example: Amylase breaking down starch
Pros: Highly selective, eco-friendly Cons: Sensitive to pH and temperature, expensive
Other Specialized Types:
- Photocatalysts (activated by light)
- Nanocatalysts (engineered at the nanoscale)
- Electrocatalysts (used in fuel cells and electrolysis)
4. Characteristics of an Effective Catalyst
| Property | Description |
|---|---|
| High activity | Accelerates the reaction significantly |
| Stability | Withstands operational conditions without decomposing |
| Selectivity | Favors desired products |
| Recoverability | Can be reused multiple times |
| Non-toxicity | Safe for humans and the environment |
5. Applications of Catalysts
Chemical and Petrochemical Industries:
- Ammonia production (Haber process) using iron catalysts
- Crude oil refining with acidic catalysts
- Desulfurization of fuels
Pharmaceuticals:
- Production of antibiotics, anti-cancer agents, and active compounds
Environmental Protection:
- Automotive catalytic converters for removing toxic gases
- Wastewater treatment for breaking down contaminants
Food Industry:
- Enzymes used in bread, yogurt, cheese, and juice production
Nanotechnology:
- Advanced catalysts for targeted and energy-efficient reactions
6. Famous Examples of Catalysts
| Reaction | Catalyst | Type |
| Ammonia synthesis | Iron | Heterogeneous |
| Hydrogenation of oils | Nickel | Heterogeneous |
| Esterification | H2SO4 | Homogeneous |
| Glucose fermentation | Enzymes (zymase) | Biocatalyst |
7. Challenges and Future Trends
While catalysts offer high efficiency, they also face challenges such as:
- High cost of precious metals (e.g., platinum, rhodium)
- Environmental and toxicity concerns
- Performance degradation over time
Future outlook:
- Development of green and recyclable catalysts
- Self-regenerating and smart catalysts
- Nanostructured and enzyme-mimicking systems
Conclusion
Catalysts are the driving force behind countless industrial and biological processes. They accelerate reactions, reduce energy usage, and enhance selectivity. Understanding their mechanisms, types, and applications helps scientists and engineers design better processes with higher efficiency and sustainability.







دیدگاه خود را ثبت کنید
تمایل دارید در گفتگوها شرکت کنید؟در گفتگو ها شرکت کنید.